有機合成において芳香族求電子置換反応は、置換基の少ない芳香環を修飾して多官能基化する有用な手法です。
いろいろな置換基を利用した芳香族求電子置換反応が開発されていますが、窒素原子がベンゼン環に置換したアニリンはその高い電子供与性のため、芳香族求電子置換反応の代表的な原料です。
オルト-パラ配向性を利用したアニリンの官能基化は信頼性の高い芳香族置換反応の一つと言えます。
目的物がアニリンの場合はいいのですが、窒素原子から何か別のものに変えたい時に大活躍するのが、今回取り上げるSandmeyer reaction(ザンドマイヤー反応、あるはサンドマイヤー反応)です。
一価の銅塩が仲介するザンドマイヤーハロゲン化反応
Sandmeyer反応は、ベンゼンジアゾニウム塩に対して銅塩を作用させて、ハロゲン化ベンゼンを得るのが基本の反応になります。
反応で使われるベンゼンジアゾニウム塩は、一般的に不安定な化学種で、爆発性が危惧されます。
そのためベンゼンジアゾニウム塩の調製は、Sandmeyer反応を行う直前にジアゾニウム化して行われます。

実際の反応はまず、原料のアニリンを亜硝酸ナトリウムと強酸で処理してジアゾニウム塩を得ます。
亜硝酸ナトリウムを強酸で処理することにより、活性種であるニトロニウムイオン等価体が発生します。
この活性種に対してアニリンの窒素原子が反応し、ついで脱水が進行することによってジアゾニウム塩が形成されます。
亜硝酸ナトリウムと強酸を使用する代わりに、有機試薬であるt-BuONOもジアゾニウム塩化に良く使われる条件ですね。
得られたジアゾニウム塩に対して、導入したい官能基を持った一価の銅塩で処理すると、一価の銅から一電子還元(Single Electron Transfer, SET)が進行し、生じたジアゾニウムラジカルから窒素の放出を経て、フェニルラジカルが生成すると考えられます。
先の一電子還元で電子を供与し、二価に酸化された銅塩とフェニルラジカルが再び反応することで、ハロゲン原子がベンゼン環に移動して、望みのハロゲン化ベンゼンが合成できるわけです。
フェニルラジカルからのハロゲン化は遊離のハロゲン化物イオンが反応する説もありますが、まぁ細かいことはいいでしょう。
多くの反応に言えますが、詳細が完全に分かっている反応はあまりなく、自分が納得、理解できるものをストックしておくのが大事だと思います。
豊富なバリエーションが魅力なザンドマイヤー反応
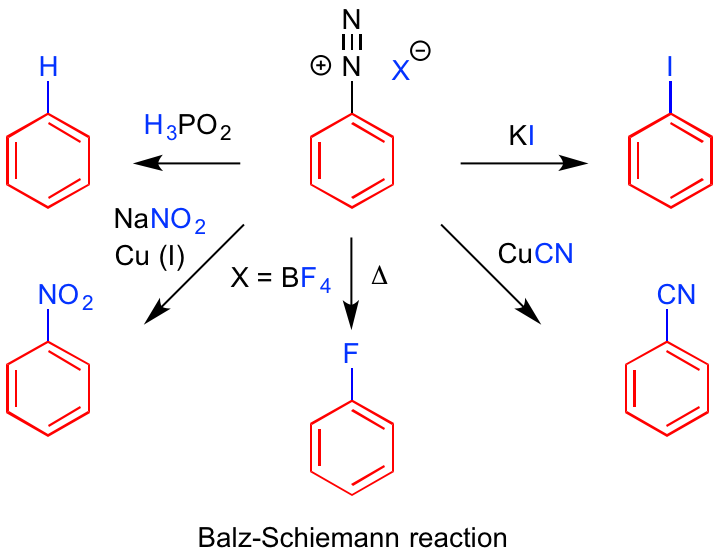
塩素や臭素などのハロゲンに加えて、シアノ基(CN)も対応するシアン化銅を用いることによって、合成できる優れた反応です。
さらにバリエーションは豊富で、ヨウ化カリウムを作用させると銅のチカラを借りずともヨードベンゼンに変換できます。
これはヨウ化物イオン自体に一電子還元できる能力があるため、ジアゾニウム塩をフェニルラジカルに誘導できるためです。
次亜リン酸を加えてもラジカル機構で反応が進行し、水素化されたベンゼンが得られ、余計な官能基を除去するのに用いることができます。
また、ジアゾニウム硫酸塩などを水とともに加熱すれば、フェニール誘導体が合成できます。アニリンから考えれば窒素原子が酸素原子に置き換わったことになりますね。
ちょっと色々ありすぎですねー。
Sandmeyer反応で大事なのが、ジアゾニウム塩作成の時に用いる強酸のカウンターアニオンを、導入したい官能基によってよく吟味する必要があることです。
塩化銅を使えば塩素が、臭化銅を使えば臭素がアニリン部分に置換できるわけですが、塩化物イオンを有するジアゾニウム塩に臭化銅を作用させると、導入されるハロゲンが混ざってしまうようです。
似た反応で、Balz-Schiemann反応(あるいは単にSchiemann反応)が知れらていますが、これはトリフルオロホウ酸イオンをカウンターアニオンとするジアゾニウム塩を加熱すると、フッ化ベンゼンが合成できるというものです。
熱条件と光条件で生成物の比率が同じこと、反応速度が一次反応であるなどの理由から、こちらの反応ではジアゾニウム塩からフェニルカチオン中間体の発生が想定されています。
まとめ
Sandmeyer反応に用いるアニリンには、無保護の水酸基やフェニール、ケトンにアルデヒドがあっても問題なく、ニトロソニウムイオンはアミノ基選択的に反応して、ジアゾニウム塩へ誘導できます。
また、銅塩との反応段階もジアゾニウム塩選択的に反応し、二段階とも非常に高い官能基選択性があります。
二段階の狙い撃ち反応の組み合わせが、アニリンが持つベンゼン環修飾能力と相まって、老舗の名店として輝く反応ですね。
関連記事です。
ジアゾニウム塩はアゾカップリングの原料としても活躍していますね。
こちらはCurtius転位の紹介記事です。窒素3連続のアシルアジドが活躍する反応です。
最も使われているアゾ化合物はAIBNですかね。ラジカル反応に欠かせない開始剤としてよく使われています。