数ある天然有機分子のなかでも、環状炭素骨格が連なった縮環構造を有するステロイド類は有名であり、コレステロールなどは生活用語にもなっているお馴染みの化合物です。
ステロイドの主骨格にみられる6員環炭素骨格シクロヘキサンは、テルペノイドをはじめとする多くの天然有機分子に存在しており、活性分子のまさに骨格として非常に重要な構造です。
今回は、発展性の高いシクロヘキサン構造のひとつであるシクロヘキセノンを合成できるRobinson環化反応(ロビンソン環化反応)について考えたいと思います。
手堅い反応の三重奏で環構造を増築するロビンソン環化
Robinson環化(Robinson annulation)はMichael付加反応、分子内アルドール反応、脱水反応の3つの反応が組み合わさって進行する環化反応です。
因みにIUPAC Gold Bookによれば、annulationとは二つの結合を新しく作りながら環構造を形成すること、同じ環化の意味で使われるcyclizationは鎖状分子から一つの結合を形成しながら環化すること、のようです。
ですので、Robinson環化では一連の反応を全部合わせてannulationと呼ばれていると考えられます。
一方で、もともと環構造があるところに追加で環を形成することをannulationと定義することもあるようです。
まぁ、地域や人によってもルールが異なるようですが。

さて、Robinson環化で使われるMichaelアクセプターで、最も有名なものはメチルビニルケトン(MVK)です。
Robinson環化は酸性、塩基性どちらの条件下でも反応が進行しますが、塩基性条件で行われることの方が多いですね。
1反応目はMichael付加反応です。
反応はまず、環状ケトンやβ-ジケトンなど求核剤として用いるケトンに対して塩基が作用し、エノレートが生じます。
このエノラートがMVKのようなα,β-不飽和ケトン(エノン)に対して1,4-付加(Michael付加)を起こします。
反応混合物を酸処理などして、この段階で反応を停止させれば1,5-ジケトン化合物が得られます。
2反応目は分子内アルドール(aldol)反応です。
得られた1,5-ジケトン、あるいはMichael付加後のフラスコに、より強い塩基を作用させると二つのケトンのα位炭素から脱プロトン化が起こります。
エノレート化できる全ての位置で脱プロトン化が進行していると考えられ、加えた塩基と生じた共役酸の作用により、脱プロトン化とプロトン化を繰り返しています。
ただ、最終的にはMVK由来のメチル基にあたる位置でのエノレート化が、もう片方のケトンに対して安定な6員環を形成するように分子内アルドール反応を起こすことができるため、反応の平衡がこちらに傾きます。
最後の3反応目が脱水反応になります。
通常、2反応目の分子内アルドール反応の塩基性によって、アルドール生成物であるβ-ヒドロキシケトンからE1cB機構により直接脱水反応が進行し、最終生成物であるシクロヘキセノンが得られてきます。
有機触媒のちからでキラルビルディングが合成できる
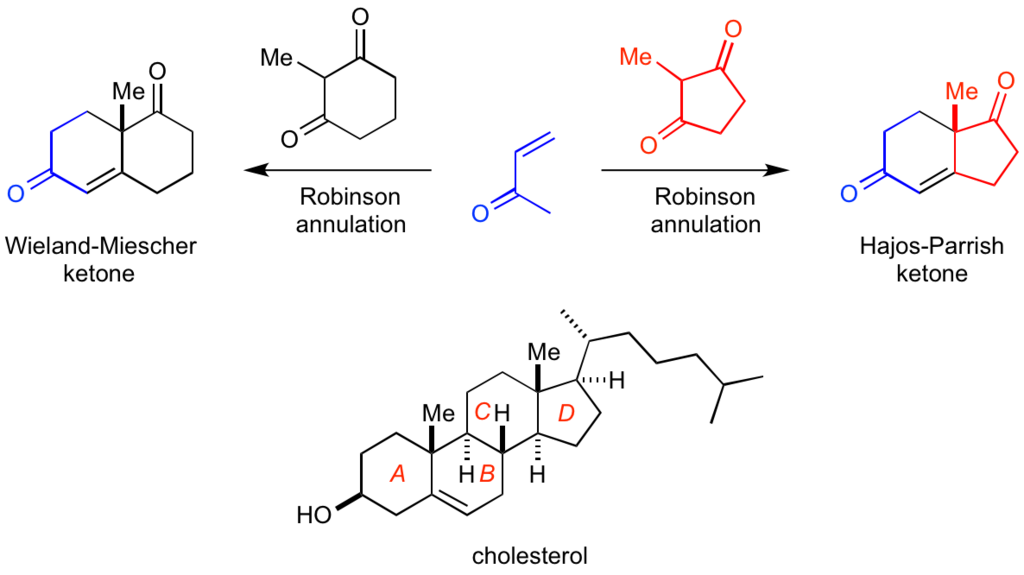
Robinson環化を利用した非常に重要なものとして、光学活性化合物の合成が挙げられます。
例えば6員環ジケトンから出発するWieland-Miescherケトンの合成は、MVKとの組み合わせにより6,6-縮環構造を有するシクロヘキセノンを合成可能であり、プロリン誘導体を触媒とする分子内アルドール反応を達成出来れば、ステロイドのAB環に相当する骨格を一挙に入手可能になります。
一方で、5員環ジケトンを出発原料に用いれば、ステロイドCD環部に相当するHajos-Parrishケトンが合成できるため、ステロイド関連化合物の誘導化を含めて非常に多くの化学者に活用されていますね。
これらの合成法は、近年急速に発展した有機分子触媒化学の先駆的な研究であり、歴史的にも非常に重要なものと言えます。
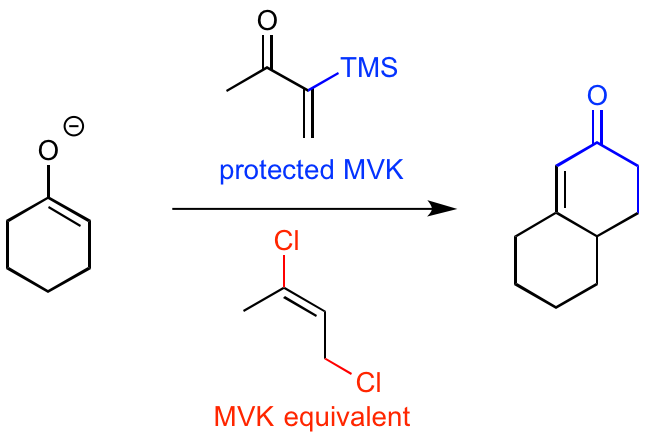
MVKを利用するRobinson環化での弱点は、初めのMichael付加の段階で、MVKがポリマーになり易い点です。
これを改善するため、MVKカルボニル基のα位にトリメチルシリル(TMS)基などの嵩高くて後に取り外し可能な置換を導入することにより、余計な副反応を抑える事が出来るようですね。
また、反応系内でエノン構造を発生させる方法も副反応の抑制に有効であり、Robinson環化の応用性の拡大に貢献しています。
まとめ
キラルな6員環エノンを信頼性高く合成できるRobinson環化は、その発見から現在に至るまで、多くの合成化学者に利用され続けています。
入手容易なケトンとエノンから、発展性の高いシクロヘキセノンへ効率的に変換できること、他の方法よりも圧倒的に簡便な操作で合成できることなど化学者に好まれる条件が揃っていると言えます。
誰もが簡単に安全に合成できる有用骨格の開発成功は、時を超えて使われ続けることの好例ですね。
関連記事です。
こちらは森田-Baylis-Hillman反応に関する紹介記事です。Robinson環化と同じように、特徴的な炭素-炭素結合形成を可能にします。
アルドール型の反応として、Mannich反応も多くの有機合成で活躍していますね。
カルボニル化合物からエキソオレフィンを作るならEschenmoser反応は一考すべき反応です。