pinacol転位は、1,2-ジオールを出発原料とする官能基の1,2-転位であり、二つの水酸基からカルボニル化合物であるケトンへと誘導できる分子変換反応です。
通常のpinacol転位では、より安定なカチオンを形成するべく、最初のカルボカチオン発生は多置換炭素上で起こることが多く、転位する位置の予測に役立ちます。
しかしながら、官能基の1,2-転位を利用した分子変換を行う際、転位の方向を逆にしたい場合が少なからずあります。
つまり、少置換炭素上の水酸基を脱離基にして、級数の大きなアルコール上の官能基を移動させたい場合です。
そんな時に活躍するのが、今回取り上げるsemipinacol転位(セミピナコール転位)です。
脱離基の制御でセミピナコール転位の方向を制御
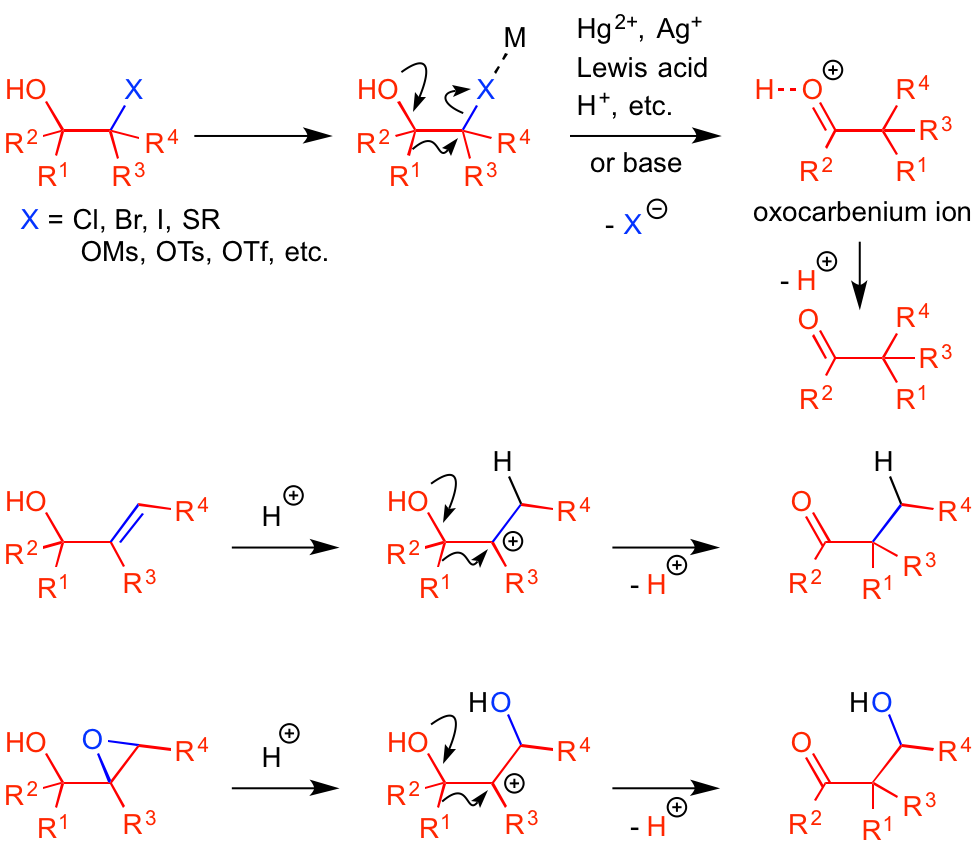
semipinacol転位の出発原料として、水酸基がついた炭素の隣の炭素(β位)にハロゲンやスルフィド、エポキシドやオレフィン、あるいはメシラート(MsO)やトシラート(TsO)などのアルコール誘導体を用意します。
これら官能基に対して、それぞれの脱離基の活性化に有効な金属イオンやルイス酸、ブレンステッド酸を作用させると、カルボカチオンもしくは部分的に炭素と脱離基の間の結合が開裂したプラス電荷を帯びた炭素が発生します。
このカルボカチオンに対して、水酸基の根元の炭素からアリール基やビニル基、アルキル基や水素原子が転位反応を起こし、σ結合ごと原子団が移動したケトン化合物を生成します。
pinacol転位と同様に本反応の駆動力は、最初に発生するカルボカチオンから、より安定なカチオンであるオキソカルベニウムイオン(oxocarbenium ion)への変換だと考えられます。
特筆すべきは転位の方向の制御能力
semipinacol転位の最大の特徴は、転位の進行方向を制御できることです。
脱離基として用いられるハロゲンや硫黄化合物の活性化には、銀カチオンや水銀イオンの利用が効果的です。
これらの金属はアルコールの酸素原子とはそれほど高い親和性を有していないため、脱離基を選択的に活性化することができます。

アルコール誘導体であるメシラートやトシラートは、単純な水酸基よりも圧倒的に脱離基として優れており、この場合も転位反応の位置を制御可能と言えます。
これらアルコール誘導体を脱離基とする場合、脱離基に誘導する際に原料としてジオールを使用することが多いです。
一般的に立体障害の少ない水酸基の方が、誘導化反応に対して活性であるため、結果的に級数の低い水酸基が脱離基に変換されます。
このアルコール誘導体に対してsemipinacol転位を行うと、pinacol転位とは対照的に、少置換炭素上でカルボカチオンを生じることになり、より級数の大きな水酸基からの電子供与に後押しされて、官能基の1,2-転位が進行します。
つまり、最終生成物であるケトンの位置は、ジオールを基質とするpinacol転位とは異なる炭素上になり、pinacol転位とは相補的な1,2-転位反応と言えます。
pinacol転位とsemipinacol転位、二つの方法をうまく選択することによって、同一の1,2-ジオールからそれぞれの目的にあった化合物へと誘導できそうですね。
まとめ
β位に脱離基を有するアルコールに対して、適切な活性化を施しカルボカチオンを発生させられるsemipinacol転位。
pinacol転位よりも温和な条件で官能基の1,2-転位を実現でき、選択性の逆転も可能です。
転位させたい原子団も、立体的・電子的な特性をうまく利用して、狙い通りに転位反応を達成したいものですね。
関連記事です。
こちらはピナコール転位の紹介記事です。お互い相補的な関係にあるので、うまく活用したいですね。
Wagner-Meerwein転位はセミピナコール転位の大本とも言える炭素骨格変換反応です。
転位反応つながりで、カルボン酸誘導体からアミンを合成できるHofmann転位を紹介しております。