医薬品や有機分子材料などにみられる官能基の中でもアミノ基は、三つの共有結合と一つの非共有電子対を有する窒素原子の特性を発揮できる基礎的官能基のひとつです。
結合角度や電子的性質、窒素上での速い立体反転を起こすなど、炭素や酸素原子とは特徴が大きく異なり、機能性有機分子になくてはならない存在と言えます。
1級アミンの立体選択的な合成は難しく、様々な求核置換反応や付加反応が開発され続けています。
今回は古典的な方法ながらも、1級アミノ基を立体選択的に合成しうるHofmann転位(ホフマン転位)を取り上げたいと思います。
ホフマン転位では1級アミドから1炭素少ないアミノ基が合成できる
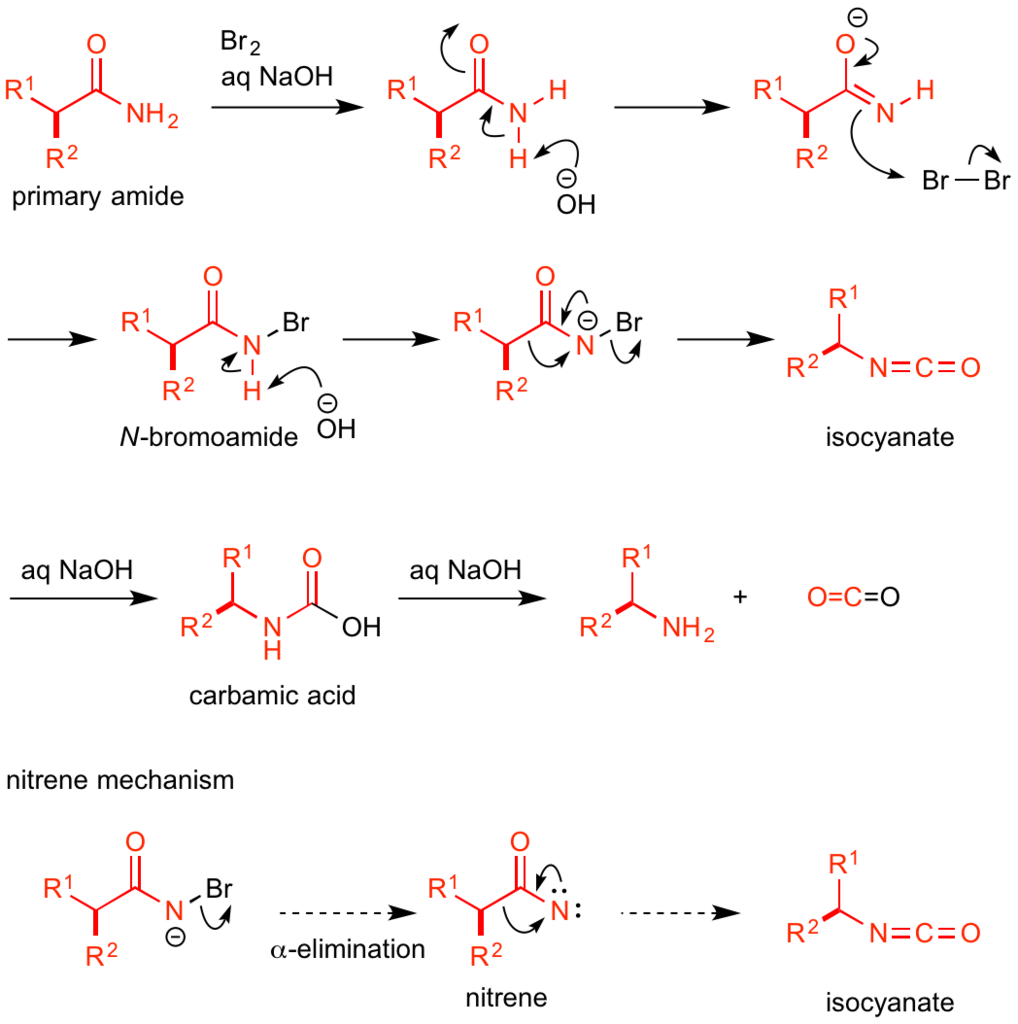
Hofmann転位の原料はカルボン酸誘導体である1級アミドです。
アミドに対してまず、塩基性条件下でハロゲン化剤を作用させてN-ハロアミドへと誘導します。
典型的な条件では臭素が用いられますが、塩基や溶媒によってはより取り扱いやすいN-ブロモスクシンイミド(NBS)なども使用可能です。
生じたN-ハロアミドは、反応系内に過剰に存在する塩基によって窒素上に残ったもう一つの水素原子が引き抜かれ、アニオンが発生します。
この窒素上のアニオンがカルボニル基に電子を押し込むのと協奏的に、カルボニル基に直結していた炭素-炭素結合が窒素原子にσ結合ごと移動し、 ハロゲン化物イオンの脱離を経て、生成物であるイソシアネートへ変換されます。
一昔前までは、アニオン中間体から先に窒素-ハロゲン結合がα脱離により切れてハロゲン化物イオンが脱離し、ナイトレン(nitrene)が生じると考えられていました。
しかしながら、計算化学の発展や反応生成物の精査により、現在ではナイトレンは経由せず、上記のようにアニオンの押し込み、炭素原子団の転位、ハロゲン化物イオンの脱離が協奏的に進行する説が有力となっています。
オリジナルの反応条件では、Hofmann転位はここで止まらずに、系内に存在する塩基性水溶液によってイソシアネートが加水分解されます。
カルバミン酸の形成と脱炭酸が進行し、対応する1級アミンが最終生成物として得られてきます。

本反応をメタノールなどアルコール溶媒で行えば、イソシアネートに対してアルコールが付加し、カルバメート(ウレタン)が生成物になります。
特に、t-ブタノールやアリルアルコール付加体はそれぞれBoc基とAlloc基であり、得られるアミンを保護基で守られた状態に直接変換できるため、合成戦略全体の効率化に大変重宝しますね。
超原子価ヨウ素試薬でより使いやすくなったホフマン転位
オリジナルのHofmann転位の条件はかなり強いものであり、特に反応基質が塩基性に弱い場合は複雑な混合物を与える場合が多いものでした。
その後の研究により、四酢酸鉛(Pb(OAc)4)やヨードベンゼンジアセタート(PhI(OAc)2)、ビストリフルオロアセトキシヨードベンゼン(PhI(OTFA)2)などの酸化剤が本反応に適用可能とわかりました。
これらの試薬は臭素などのハロゲン化剤に比べて扱いやすく、現在ではこちらの条件が主流となりつつありますね。
多くの反応がより使いやすくなり、大変便利な世の中ですな。
まとめ
カルボン酸誘導体である1級アミド化合物から、一炭素減らしながらアミンへ誘導できるHofmann転位は、Curtius転位と類似の反応になります。
Curtius転位の中間体であるアシルアジドよりも安定な1級アミドを原料にできる点など良い点もありますが、カルボン酸からの誘導が容易なCurtius転位の方がよく使われる印象でしょうか。
いずれにしても、σ結合ごと転位が進行するのため、前駆体のカルボン酸誘導体の立体化学をきちんと構築できれば、立体保持で転位ができ、大変有用なアミン合成法です。
関連記事です。
Hofmann転位の最大のライバル、クルチウス転位に関する記事です。こちらも立体保持で炭素原子団が移動して来ます。
アミンを合成する手法としてMannich反応も覚えておきたい反応です。
Hofmannつながりで脱離反応も紹介しておきますね。