アリルアルコールから2炭素以上の炭素鎖伸長を実現できるClaisen転位は、新しく生成する炭素-炭素結合においてアリルアルコールの立体化学転写が特異的に進行するため、多くの有機合成に取り入れられてきました。
本当に素晴らしい分子変換反応では、より使いやすくするために後の研究者によって改良法が提案されることがしばしばあります。
Johnson-Claisen転位とIreland-Claisen転位は、Claisen転位反応の幅を大きく広げた改良法ですが、反応の進行にそれぞれ、酸性、塩基性条件が必要であり、原料によっては利用できないことがあります。
今回紹介するEschenmoser-Claisen転位(エッシェンモーザー・クライゼン転位)は、よりマイルドな中性条件でClaisen転位が実現できる有効な化学反応です。
[3,3]-シグマトロピー転位でアミドが合成できるエッシェンモーザー・クライゼン転位
Eschenmoser-Claisen転位で主に使われる試薬は、ジメチルアセトアミドジメチルアセタールです。
この試薬は、溶媒としても使われるジメチルアセトアミド(DMA)のカルボニル部分がジメチルアセタール化されたものですね。

ジメチルアセトアミドジメチルアセタールを加熱すると、ジメチルアミンの窒素原子からの電子の押し込みによるメトキシ基脱離が促進され、イミニウムカチオンが形成されます。

このイミニウムカチオンに対して原料のアリルアルコールが付加反応を起こすと、メトキシドによる脱プロトン化を伴いながら、原料を含むアセトアミドのアセタール構造がつくられます。
加熱条件下、再び窒素原子からの電子の押し込みによりアルコキシドが脱離するのですが、試薬由来の残ったメトキシ基が離れていくと、原料を含むイミニウムカチオンが形成されます。
続いてイミニウムカチオンからエナミンを形成するように、メチル基の水素原子が脱プロトン化されると、Claisen転位に必要なアリルビニルエーテル構造ができるわけです。
加熱条件はClaisen転位も促進し、[3,3]-シグマトロピー転位によって二重結合と単結合の移動が起こると、生成物として2炭素増えたアミドが得られます。
結果的に、原料であるアリルアルコールの炭素-酸素結合が切断されると同時に、新しい炭素-炭素結合が形成されていますね。
他のClaisen転位と比べたEschenmoser-Claisen転位の特徴は、やはり中性条件で反応が進行する点にあります。
加熱するだけで、ジメチルアセトアミドジメチルアセタールから活性種であるイミニウムカチオンを発生させられます。外部から酸や塩基を加える必要がなく、反応途中で生じるメトキシドも原料由来のアルコールの脱プロトン化に寄与するため、トータルでいつも中性を保てるわけですね。
アミドの反応性を利用したクライゼン転位後の変換反応
Claisen転位で得られるγ,δ-不飽和カルボニル化合物は、後の変換反応の足掛かりに有利な官能基群です。
特にEschenmoser-Claisen転位の生成物であるアミドは、他のClaisen生成物よりも優れた分子変換を可能にします。
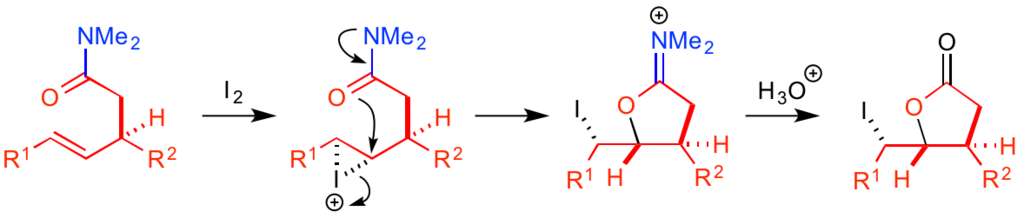
例えばヨードラクトン化反応では、ジメチルアミノ基の窒素原子から電子が押し込まれたカルボニル基の反応性が高く、ヨウ素によって活性化された炭素-炭素二重結合に対してスムーズに環化反応を引き起こします。
LAH還元を行えばアミンが得られますし、それに続いて過酸化物でアミノ基を酸化すればCope脱離によって、メチル化すればHofmann脱離によってオレフィン化合物へも無駄なく変換できますね。
まとめ
Eschenmoser-Claisen転位は、Johnson、Irelandらの改良法に並ぶ、クライゼン転位の三大活用法です。
100度以上の温度が必要なのがネックですが、生成物の先に待ち構えるターゲットを見据えて、最良の方法を選んでいきましょう。
関連記事です。
Johnson-Claisen転位に関する記事です。長男ですね。
Ireland-Claisen転位は長女です。強塩基が必要ですが、溶媒によってジアステレオ選択性を制御する細やかさがあります。
4級アンモニウム塩までメチル化すればHofmann脱離が可能ですね。