医薬品や機能性材料など、人類にとって価値の高い有機分子を供給することは、有機合成化学の醍醐味のひとつです。
炭素-炭素結合を中心に構成される有機分子ですが、周期表で炭素原子の隣にある窒素原子との炭素-窒素結合(C-N結合)も非常に重要で、多くの有用分子骨格に組み込まれています。
特に、アニリンやカルバゾールなどに見られる芳香族炭素と直接連結するアミノ基は、芳香環の電子状態に大きな影響を与えることができ、医薬品や機能性有機分子に無くてはならない置換基と言えます。
今回は、芳香族ハロゲン化合物とアミンの間でC-N結合が形成できるBuchwald-Hartwig(バックワルド-ハートウィグ)アミノ化反応を取り上げたいと思います。
アミンと芳香族ハロゲン化合物の連結
鈴木-宮浦カップリングや右田-小杉-Stilleカップリングなどを中心に、芳香族ハロゲン化合物を出発原料とした炭素-炭素結合(C-C結合)形成反応は、以前から精力的に研究がなされてきました。
一方で、炭素-窒素結合(C-N結合)形成への芳香族ハロゲン化合物の利用は、右田先生、小杉先生らによるジエチルアミノスズ化合物とのカップリングに限られるなど、その発展が大きく遅れていました。
そのような背景の中、MITのBuchwald教授とYale大学のHartwig教授は同時期に、パラジウム触媒による芳香族ハロゲン化合物とアミン(NH)のカップリング反応を見出しました。
Buchwald-Hartwigアミノ化の反応機構

Buchwald-Hartwig反応の提唱されている代表的な反応機構では、以下の素反応が重要な段階だと考えられます。
1) 0価パラジウムの芳香族ハライドへの酸化的付加
2) 酸化的付加で生じたパラジウム2価へのアミンの配位
3) 塩基による配位アミンの脱プロトン化
4) 還元的脱離による0価パラジウムの再生と目的物の生成
これら4つのステップがすべて効率よく進行し、触媒サイクルが回ることによって、芳香族C-N結合が形成できます。
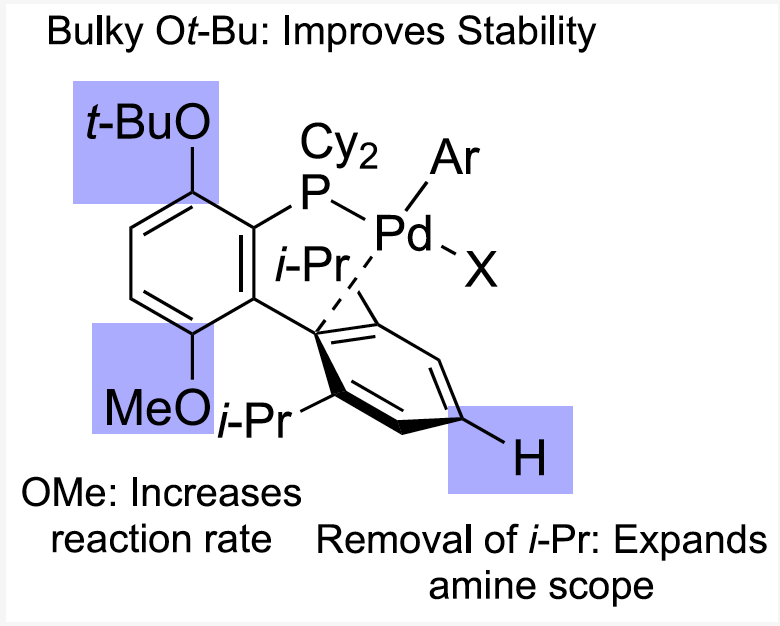
各段階が円滑に進行するためにはパラジウム配位子(リガンド)の選択が非常に重要ですが、Buchwald教授らによって開発されているリガンド、特に2020年JACSに報告されたGPhosの設計指針に基づいて各段階を見て行きましょう。
"Development of an Aryl Amination Catalyst with Broad Scope Guided by Consideration of Catalyst Stability"
S. D. McCann, E. C. Reichert, P. L. Arrechea, S. L. Buchwald, J. Am. Chem. Soc. 2020, 142, 15027-15037. DOI: 10.1021/jacs.0c06139
(GPhos-supported catalyst 出典:原著論文)
酸化的付加
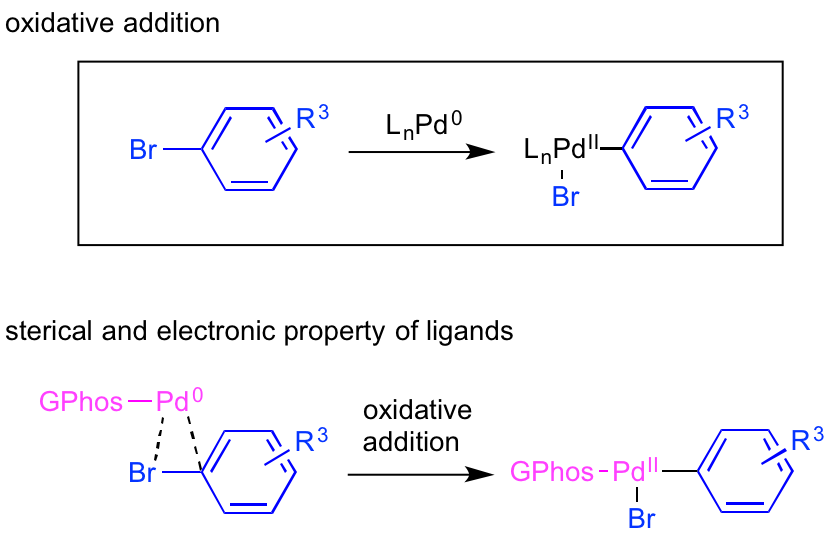
酸化的付加の過程では、0価のパラジウムが炭素-ハロゲン結合(C-X結合)に作用し、形式的にプラスの電荷を持った2価パラジウムに酸化されます。
そのため、パラジウム金属周辺の環境としては
・C-X結合にアクセスしやすい立体障害の少ない状態
・反応で生じる2価パラジウムを安定化させる電子豊富なリガンドが配位している
・0価パラジウムが反応系外に落ちてしまわない強固な配位構造
などが好ましいと考えられます。
パラジウム原子は、窒素やリン原子に代表されるヘテロ原子から複数の配位を受けることがほとんどです(L2~4Pd0型)。
一方、Buchwald教授らが精力的に研究しているジアルキルビアリールホスフィンリガンドは、パラジウム1原子に対して堅牢な構造を有する1つのリガンドが配位するL1Pd0型だと考えられており、少ないリガンド配位数で立体障害を軽減し、パラジウムのAr-Xへの酸化的付加を促進しています。
さらに、二つのアルキル基を有するリン原子は、電子豊富なリガンドとしてパラジウム金属の酸化的付加を補助しています。
アミンの配位 & 脱プロトン化
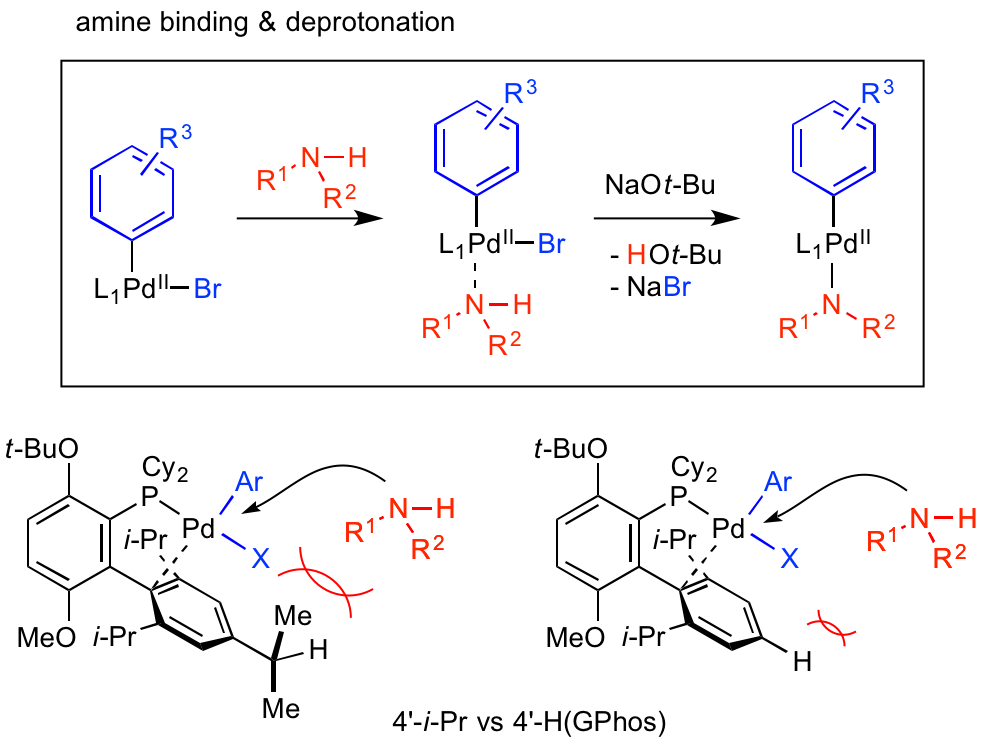
次の過程である、2価パラジウムへの基質アミンの配位では、以下のような環境が好ましいと考えられます。
・2価パラジウム周辺が基質アミンが配位できる空間がある
・C-N結合形成に不利な過剰アミン配位状態を抑制できる、あるいは過剰アミン配位状態から触媒サイクルに戻せる能力のあるリガンドが存在する
特にGphosリガンドの場合、4'位に存在するイソプロピル基を水素原子に変更し、アミンのパラジウムへの配位が促進されています。
これにより、立体障害の大きな基質アミンを用いても室温・短時間でのC-N結合形成を達成できたようです。
興味深いことに、通常反応活性が高いとされる芳香族ヨウ化物Ar-Iを用いたC-N結合形成は、Buchwaldリガンドを用いると臭化物Ar-Brに比べて反応が遅いことがあるようでした。
これは、酸化的付加した2価パラジウムに原子半径の大きなヨウ素が置換しているため、基質アミンの配位が遅いためと推察されていますが、4'位が水素原子のGPhosなどではアミンの配位が促進されているため、ヨウ化物Ar-Iを用いてもC-N結合形成がスムーズになったようです。
臭化物Ar-Brや塩化物Ar-Clで進行する反応を、わざわざ高価なAr-Iで行う人は少ないかもしれませんが、アミンの配位に立体障害が重要なことがうかがい知れる知見ですね。
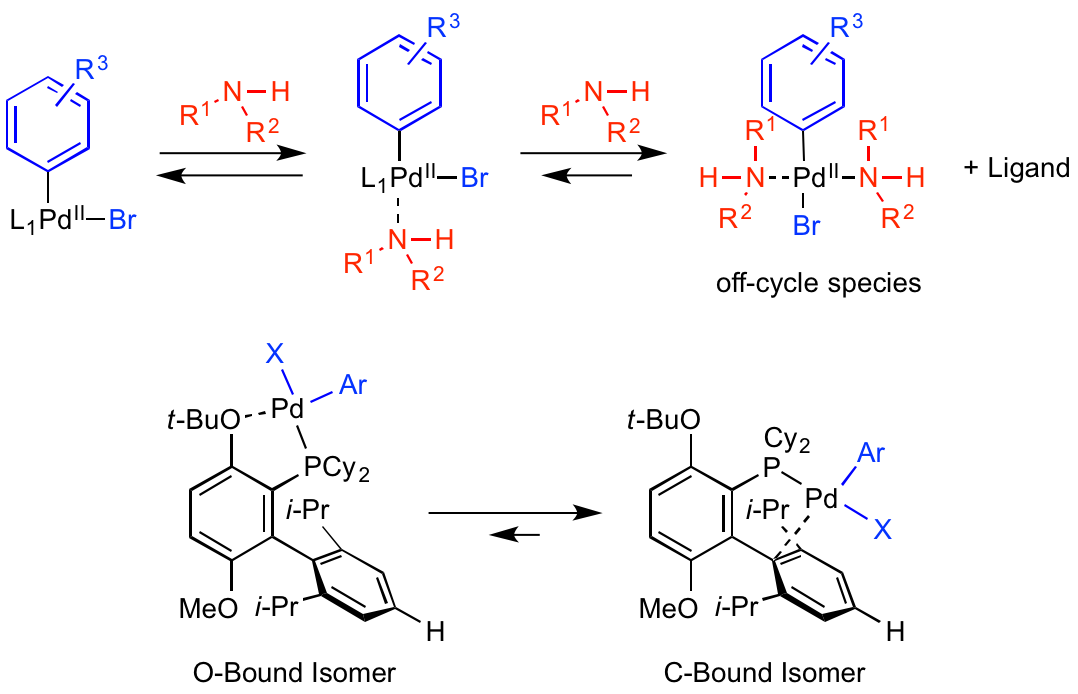
また過剰アミン配位状態による不活性化は、通常のBuchwald-Hartwigアミノ化反応で高温が必要な理由の一つのようです。
触媒に対して原理上過剰に存在する基質アミンにより、どうしてもPdからリガンドが外れた状態ができやすいのですが、加熱によりリガンド交換を促進させ、触媒サイクルに戻していると推察されます。
Buchwald研の継続的な検討により、そもそも基質アミンの過剰配位状態になりづらい、かつ不活性状態になっても触媒サイクルに戻り得るリガンド、が開発されています。
特に今回紹介しているGPhosでは、リン原子のオルト位に嵩高いt-BuOが置換しており、ビアリール炭素とパラジウムが相互作用するC-Bound型の安定化が促されています。
C-Bound型の安定化により、パラジウムへのアミンの過剰配位状態がこれまでより大幅に抑制され、室温での触媒活性維持に大きな役割を果たしました。
脱プロトン化に用いられる塩基は通常NaOt-Buが選好されていますが、適切な塩基性、生じる塩NaXの溶解性など、バランスの良い塩基として使用されています。
用いる反応系によっては、塩基性のより弱いNaOPhやNaOMeなどが適しています。
還元的脱離
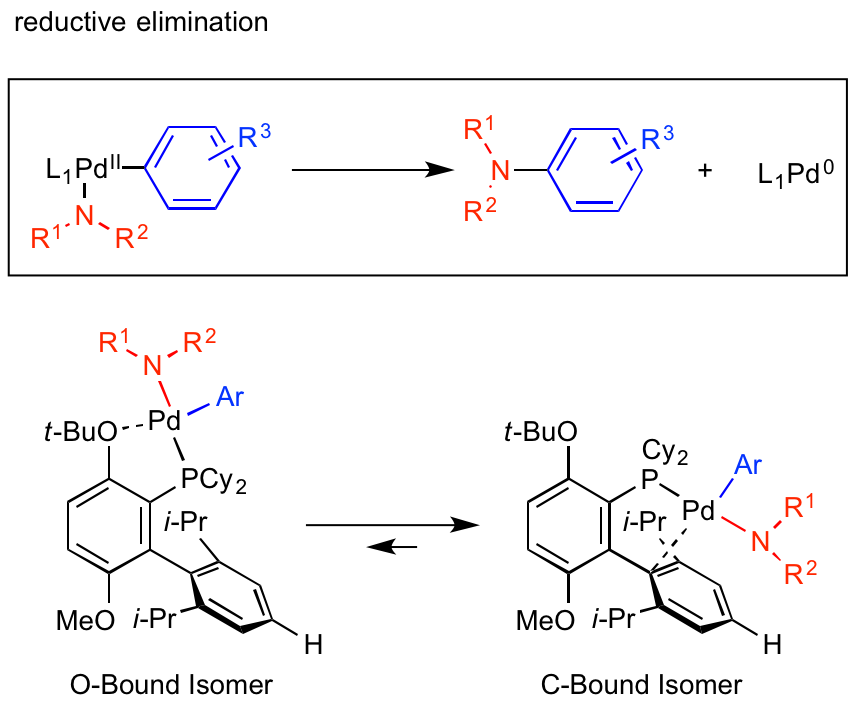
最後の過程である還元的脱離では、
・立体障害低減を駆動力とさせる配位子
・2価パラジウムから0価パラジウムに変化しても乖離しない堅牢な配位子構造
などが一般的に良いとされています。
リン原子上に嵩高いアルキル基であるシクロヘキシル基(Cy)やビアリール上にイソプロピル基を配置させることで、還元的脱離による立体障害低減をより顕著にすることができます。
先に紹介したt-BuO基によるC-Bound型構造の安定化も、還元的脱離の遅いO-Bound型を避けるという意味で最終工程を加速していると言えます。
まとめ
Buchwald教授らのGPhosリガンドの設計指針を中心に、Buchwald-Hartwigアミノ化反応を紹介してきましたが、各素反応をいかに促進させるかは多くの精密有機合成に通ずるものがあります。
芳香族ハロゲン化合物とアミンの連結で蓄積されたこれらの知見が、新たな有機合成を可能にし続けてくれることと思います。
とらおも皆さんも有機合成に携わる者として、次の世代に残せる知見を見出して行きたいものですね。
関連記事です。
こちらはパラジウム触媒によるC-C結合形成の代表反応、鈴木-宮浦カップリングに関する記事です。